电话:4008-508-928
手机:0592-6102588
邮箱:sales_52@optosky.com
在不同PH值中,用拉曼光谱仪检测纤维二糖酶主链构象是否有异同?
拉曼光谱是一种散射光谱,目前已广泛应用于材料、化工、石油、高分子、生物、环保、地质等领域。拉曼光谱是研究分子振动的一种光谱方法,它可以提供关于分子内部各种简正振动频率及有关振动能级的情况,从而可以用来鉴定分子中存在的官能团。它的谱线强度取决于相应的简正振动过程中极化率变化的大小。
蛋白质受外界因素如温度、pH、紫外辐射等影响而发生构象变化,即分子内部原有的高度规则性的空间排列和折迭方式发生变化,致使原物理、化学、生物性质部分或全部丧失。目前,在蛋白质的构象研究中,特别是溶液中蛋白质大分子空间结构与功能相互关系的动态研究中,激光拉曼光谱已成为很有前景的新技术。从蛋白质的拉曼光谱可以得到有关它的芳香族组成氨基酸的信息,还能进一步得到二级结构的信息。有关利用拉曼光谱分析多肽及蛋白质构型的研究国内外均有报道。Ellepola等吲研究了大米球蛋白在各种处理方式下拉曼光谱的变化。周殿凤等利用拉曼光谱分析、研究了紫外辐射对牛血清白蛋白影响。余多慰等对绿色木霉(Trichoderma viride)纤维素酶中的CBH 11(Cel—lobiohydrolaseⅡ)在固态以及两种pH的液态中酶分子的侧链构象与侧链环境状态进行了拉曼分析,揭示了活性中心酪氨酸的作用。
本实验室在绿色木霉产纤维素酶的发酵过程中,观察到纤维二糖酶(Cellobiase,CB)受pH的影响显著,是限制纤维素水解的重要因素。为此,本文采用拉曼光谱分析了纤维二糖酶经不同pH处理后蛋白构象的变化,并对其主要的碳链与侧链构象进行研究。
1 材料与方法
1.1材料和仪器
采用本实验室分离得到的纤维二糖酶(由绿色木霉产生),浓度为0.1 g/L。激光显微拉曼光谱仪(invia+Reflex),英国Renishaw公司生产。
1.2实验方法
取酶液,用HCl调节pH为5.0和2.0,测定纤维二糖酶酶活。酶活测定按文献[6]进行。另取酶液在室温(22℃)进行拉曼光谱分析。激发光波长785 nm,发射功率300 mW。每个样品都重复扫描3次以上,各样品的拉曼谱图都由计算机作信号累加平均并绘图输出,峰位误差小于±3cm-1
2 结果与讨论
2.1 pH对纤维二糖酶酶活的影响
在pH 5.0和pH 2.0下测定纤维二糖酶酶活,将pH 2.0调回至5.0之后再测定酶活,以pH 5.0时测定酶活为100%。
纤维二糖酶在pH 2.0时酶活只有pH 5.0的1.0%,即使回调至pH 5.0之后,酶活也没有恢复,说明在强酸性条件下,纤维二糖酶构象上有所变化,致使酶活发生不可逆变化。为此对纤维二糖酶在pH 5.0和pH 2.0下进行拉曼光谱分析,考察其构象变化。
2.2 pH对纤维二糖酶主链构象的影响
pH 5.0和pH 2.0下纤维二糖酶的拉曼谱图如图1,其拉曼频移和归属指认见表1。
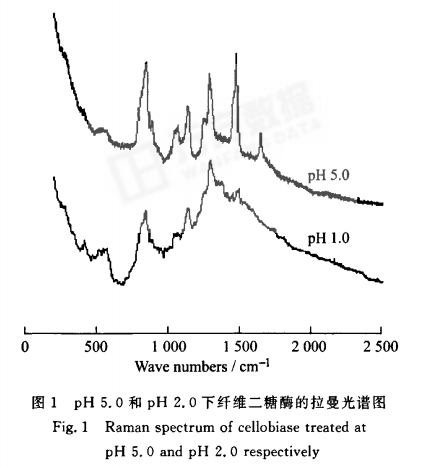
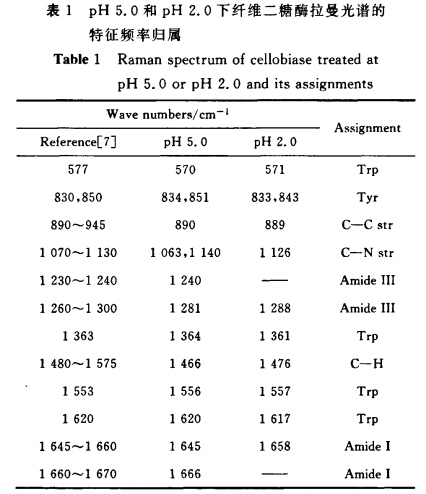
纤维二糖酶主链的构象主要由酰胺I和酰胺Ⅲ的拉曼特征峰确定,酰胺I拉曼特征峰位置为:口-螺旋结构:1 645--一1 660 em~;p折叠结构:1 665"~1 680 emq,p-回折:1 680~1 690 em~;无规则卷曲结构:1 660~1 670 cm~。酰胺Ⅲ拉曼特征峰位置为:俨螺旋结构:1 265~1 300 cm~;p折叠结构:1 230 1 240 cm~;p回折:1 305 cm~;无规则卷曲结构:1 240 1 260 cm~。‘在pH 5.0的纤维二糖酶溶液中,酰胺I谱带出现在1 645 cm-1和1 666 am一,酰胺Ⅲ谱带分别出现在1 240 cm_1和1 281 cm.‘。另外在890 cm_1出现了C—C伸缩振动吸收峰,1 063 cm.1和1 140cm-1出现了C—N伸缩振动峰,1 466 cm叫出现了C—H伸缩振动峰。由此表明,在pH 5.0溶液中的纤维二糖酶主要含有a一螺旋结构和无规则卷曲结构。
在pH 2.0的纤维二糖酶溶液中,酰胺I谱带出现在1 658 cm~,酰胺Ⅲ谱带出现在1 288 cm~。而在pH 5.0时出现的酰胺I谱带1 666 cm-1和酰胺Ⅲ谱带1 240 cm_1并没有很强的吸收峰。这两个谱带正是无规卷曲结构对应的谱带,说明在pH 2.0的时候,纤维二糖酶中无规则卷曲结构被破坏了。另外在889 ClTI_1出现了C—C伸缩振动吸收峰,1 126 cm_1出现的C—N伸缩振动峰和1 476 cm叫出现了C—H伸缩振动峰,都与pH 5.0时峰位置有所不同,而且峰强也有所下降。由此表明,在pH2.0的纤维二糖酶溶液中主要含有口一螺旋结构。pH从5.0到2.0的变化使纤维二糖酶的结构中的无规则卷曲结构受到很大影响,口一螺旋结构也受到一定影响,酶构象变化,稳定性下降。
2.3 pH对纤维二糖酶侧链环境的影响
蛋白质某些残基的侧链拉曼光谱对环境变化敏感。由酪氨酸对羟苯基环的呼吸振动和环平面外弯曲振动的倍频之间的费米共振引起的850 cm叫和830 cm_1左右的特征峰是构象灵敏的谱线[7],随侧链微环境而变化。当强度比J。。。/J啪≥1时,该酪氨酸是“暴露的”;J啪/J啪<1时,该酪氨酸则是“埋藏的”。在pH 5.0时其峰位为834 cm-1和851 cm~,而在851 cm.1的峰强明显低于834 cm.1的峰强,可得Jsso/is。o<1;而在pH 2.0时其峰位为833 cm.1和843 cm~,而在843 ca2_1的峰强明显高于833Ca2-1的峰强,可得J啪/f啪≥1。由此可知,纤维二糖酶溶液在pH 5.0时酪氨酸为“埋藏式”,当pH2.O时为“暴露式”。在色氨酸残基的一系列谱带中,1 361 cm-1谱带对于环境和聚集状态的改变是敏感的。当色氨酸残基的吲哚环处于“埋藏式”时,该谱线呈尖锐的峰形。在pH 5.0的纤维二糖酶溶液中,其峰位为570,1 364,1 556和1 620 cm_1;在pH 2.0的纤维二糖酶溶液中,其峰位为571,1 361,1 557和1 617 cm~。1 364 cm_1的峰强比1 361 cm-1的峰强高出很多,而且是尖锐的峰形,而1 361 cm_1的峰形为不明显的肩峰,可见纤维二糖酶在pH 5.0时色氨酸为“埋藏式”,而在pH为2.0时是“暴露式”。另外在500~550 cm-1内并没有出现强的S—S伸缩振动谱带,这可能说明纤维二糖酶并不含有二硫键。
3 结论
蛋白质(酶)为由氨基酸连接成链的肽键组成,在肽链的不同部分之间,存在着静电的相互作用。静电吸引有助于维持蛋白质的构象,静电排斥可以使蛋白质的稳定性下降,导致构象松散或变化。从本实验测定的拉曼光谱结果来看,纤维二糖酶在pH 5.0的溶液中,其结构为口一螺旋和无规则卷曲;在pH 2.0时则主要为a一螺旋结构,其主链构象中的无规则卷曲发生较大变化,口一螺旋也受到一定影响。纤维二糖酶侧链中的酪氨酸和色氨酸在pH5.0时均为“埋藏式”,而在pH 2.0时均为“暴露式”。此外,在500~550 cm_1并没有出现强的S—S伸缩振动谱带,这可能说明纤维二糖酶并不含有二硫键。结合在两种pH情况下纤维二糖酶酶活的分析,表明pH变化对纤维二糖酶构象的改变是造成酶活差异的主要原因,这对于进一步分析纤维二糖酶的活性中心与其构象的关系具有重要的意义。

